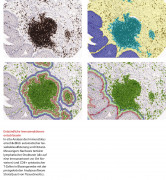
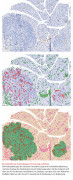
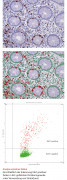
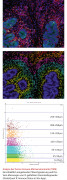
Der Ursprung von TissueGnostics liegt in einem Bedürfnis – dem Bedürfnis von Wissenschaftlern und Diagnostikern, molekulare Marker und einzelne Zellen im Gewebe zu quantifizieren, um besser zu verstehen, warum und wie bestimmte Krankheiten wie Krebs oder Autoimmunerkrankungen entstehen und fortschreiten. Der menschliche Körper verfügt über umfangreiche Selbstkontroll- und Abwehrmechanismen, um sich sowohl gegen Veränderungen des genetischen Codes durch Mutationen als auch gegen Eindringlinge aus der Umwelt (Viren, Bakterien, Parasiten,
Toxine) zu schützen.
Krankheiten treten – wie bei den meisten Katastrophen – auf, wenn mehrere dieser Sicherheitsmechanismen gleichzeitig versagen. Der gemeinsame Nenner in der biomedizinischen Forschung rund um den Globus ist das Verständnis der molekularen und zellulären Mechanismen der Homöostase (der „inneren biologischen Stabilität” eines Organismus) und die Suche nach potenziellen Zielen für therapeutische Maßnahmen.
Geschichte der Pathologie
Es war um 1850, als der deutsche Arzt Rudolf Ludwig Carl Virchow erkannte, dass Zellen die Quelle von Krankheiten sind. Obwohl die Geschichte der Pathologie bis in die frühen 1700er-Jahre zurückreicht, wird Virchow als Begründer der Zellularpathologie und damit als Pionier der modernen Histopathologie bezeichnet.
Nach der bahnbrechenden Arbeit von Virchow und anderer Pioniere analysierten Pathologen Gewebe, indem sie hauchdünne Schnitte von Organen anfertigten, diese unter dem Mikroskop betrachteten und Muster in den Gewebestrukturen verglichen sowie die Morphologie der Zellen beschrieben.
Seit den 1970er-Jahren stehen modernere molekulare Methoden zur Verfügung, die es erlauben, über anatomische und morphologische Beschreibungen hinauszugehen und auch subzelluläre Strukturen und spezifische Moleküle zu untersuchen (durch eine Technik, die als „Immunhistochemie” bekannt ist) sowie den genetischen Hintergrund (durch verschiedene Methoden, die „In-situ-Hybridisierung” bezeichnet werden) von erkrankten Zellen zu untersuchen. Solche Funktionsanalysen einzelner Zellen sind als „Zytometrie” bekannt und stehen im Gegensatz zur „Anatomie” und „Morphometrie”, die die Morphologie von Zellen und Gewebestrukturen beschreiben, aber die funktionellen Aspekte außer Acht lassen.
Die Computer- und Internetrevolution, die zu unseren Lebzeiten stattgefunden hat, betrifft „natürlich” auch den Bereich der Medizin und der Diagnostik. Ende der 1980er- Jahre verbreitete sich die Idee der „Telepathologie”, die sich auf die visuelle Analyse von Gewebeproben über ein Videosignal bezog.
Diese Idee wurde in den späten 1990er- und frühen 2000er- Jahren dahingehend erweitert, dass die Bilder in digitaler Form erfasst und archiviert wurden – eine Technologie, die als „digitale Pathologie” bezeichnet wird, wobei die Analyse/Diagnose immer noch visuell von einem menschlichen Experten durchgeführt wird.
Neueste Entwicklungen in der digitalen Pathologie
In den letzten zwei Jahrzehnten haben Wissenschaft und Industrie weltweit große Anstrengungen unternommen, um Lösungen für die digitale Diagnose zu entwickeln. Die Automatisierung der Laborforschung und der klinischen Routine ist ein bedeutender Fokus gewesen, wobei die Senkung der Arbeitskosten ein wichtiges, aber nicht das einzige Thema ist. Andere Triebkräfte der Entwicklung sind zumindest ebenso wichtig: (i) die Verbesserung der Datenqualität und der diagnostischen Präzision und (ii) die Bereitstellung von Qualitätsdaten für Patienten, die in einem Umfeld mit beschränkten Ressourcen leben – man denke nur an den weltweit zunehmenden Mangel an Pathologen und den begrenzten Zugang zu Gesundheitsdiensten in ruralen Gebieten und/oder Entwicklungsländern.
Um die Ursachen von Krankheiten zu verstehen und Therapien zu finden, müssen Daten und Wissen auf mehreren Ebenen integriert werden: Genetik, Proteinchemie, Interaktionen zwischen Enzymen und Hormonen, Immunreaktionen, toxikologische und pharmakologische Aspekte sowie kulturelle, soziale und Umwelteinflüsse.
Die Korrelation multiparametrischer Datensätze und die Ableitung effektiver Erkenntnisse in einem ganzheitlichen Ansatz wird jedoch schnell zu einem komplexen Unterfangen. Während die kognitiven Fähigkeiten des menschlichen Gehirns und seine Fähigkeit, mit „unscharfen Daten” umzugehen und in unterschiedlichsten Situationen zu interpolieren (d.h. Lösungen für nur teilweise verstandene oder in ihrer Kausalität sogar unbekannte Probleme zu finden, also eine Zwischenlösung zu finden), zweifelsohne bewundernswert sind, ist der Umgang mit Komplexität und das Erkennen multiparametrischer Zusammenhänge nicht die Stärke unserer neuronalen Schaltzentrale. Die Verarbeitung und Korrelation riesiger und komplexer Datenmengen ist jedoch genau die Stärke von KI-Systemen.
Die Kombination moderner biochemischer und genetischer Methoden mit neuesten Softwaretools und der Leistung von Computern ermöglicht den Übergang zur sogenannten Histopathologie der nächsten Generation. Während sich die klassische „digitale Pathologie” auf die Digitalisierung von
Objektträgern bezieht (die Analyse erfolgt jedoch weiterhin visuell), konzentriert sich dieser neue Ansatz auf die digitale Analyse. Das 2003 gegründete österreichische Unternehmen TissueGnostics ist mit seinen Geräten und seiner Software für die Gewebezytometrie (d.h. die automatische und quantitative Analyse von molekularen Markern auf Einzelzellebene in ganzen Gewebeschnitten) ein Pionier auf diesem Gebiet und hat sich zu einem weltweit agierenden Trendsetter entwickelt, mit Niederlassungen und Büros auf allen Kontinenten.
Da es sich bei der medizinischen Diagnose um ein reguliertes Geschäft handelt und alle Systeme (sowohl Instrumente als auch reine Softwarelösungen) strengen rechtlichen und qualitativen Anforderungen genügen müssen, sind dem Einsatz von künstlicher Intelligenz in der Medizin „künstliche Grenzen” gesetzt.
Nicht nur, dass Unternehmen, die solche Lösungen entwickeln, nach ISO 13485, der Verordnung über In-vitro-Diagnostika (IVDR), der Medizinprodukte-verordnung (MDR) und/oder ähnlichen Regelwerken zertifiziert sein müssen, auch Haftungsfragen werden die Unternehmen in absehbarer Zeit weitgehend davon abhalten, echte digitale Diagnosen anzubieten, unabhängig davon, was technisch möglich sein wird. Stattdessen werden computergestützte Diagnosesysteme, ob sie nun auf KI basieren oder nicht, als technische Mittel zur Unterstützung menschlicher Experten als „Entscheidungsunterstützungssysteme” eingesetzt.
Derzeit stehen wir noch vor technischen Herausforderungen, da die KI in der Medizin noch ein neues und wachsendes Feld ist. Außerdem müssen wir uns mit der Auffassung unserer Gesetzgeber auseinandersetzen – die wahrscheinlich die große Mehrheit der Patienten vertreten –, dass diagnostische Entscheidungen von menschlichen Experten und nicht von Computern getroffen werden müssen. Diese Menschen müssen für ihre Entscheidungen Haftung übernehmen, wenn auch in unterschiedlichem Maße je nach Region, in der
sie tätig sind.
Der Beitrag von TissueGnostics
Für die Zusammenarbeit mit der Wissenschaft hat sich TissueGnostics an zahlreichen kooperativen Forschungsprojekten mit Forschungseinrichtungen in ganz Europa beteiligt – darunter fünf von der EU geförderte Marie Skłodowska-Curie Innovative Training Networks (ITN) wie HELICAL, ein Projekt mit Schwerpunkt auf maschineller, lerngestützter Gesundheitsinformatik, das von einer Forschungsgruppe am Trinity College in Dublin geleitet wird (https://helicalitn.eu/about us/). Weitere Forschungspartner sind das Institut für Artificial Intelligence und Entscheidungsunterstützung an der Medizinischen Universität Wien und das Software Competence Center Hagenberg (SCCH) in Oberösterreich mit einem Projekt, das sich mit der Sicherheit für gemeinsam genutzte künstliche Intelligenzsysteme befasst (Projekt S3AI https:// www.s3ai.at/home.html).
Gegenwärtig agiert TissueGnostics in einem globalen Umfeld mit hochdynamischen Technologien und einem pulsierenden Life-Science-Markt, mit neuen Akteuren, umfangreichen Investitionen und beachtlichen Erfolgen. Im September 2021 ließ die US Food and Drug Administration FDA (Behörde für Lebens- und Arzneimittel) zum ersten Mal in der Geschichte ein KI-basiertes System zur Entscheidungsunterstützung für die Diagnose von Prostatakrebs zu. Dies war ein wegweisendes Ereignis, das die Beschleunigung des globalen Entwicklungstrends zur KI-gestützten Präzisionsmedizin widerspiegelt und als Referenz für künftige Anwendungen dienen wird.
Aktuelle Herausforderungen
Zwei aktuelle Forschungsbereiche innerhalb der KI, die für die künftige Ausweitung der KI in der Medizin von entscheidender Bedeutung sind, betreffen (i) die Frage, wie Computer voneinander lernen können, und (ii) das Verständnis dafür, warum eine bestimmte KI-Technologie eine bestimmte Leistung erbringt.
Ein wesentlicher Unterschied zwischen biologischer und virtueller Intelligenz besteht darin, dass der Mensch sein ganzes Leben lang lernt und neues Wissen auf vorhandenem Wissen aufbaut, selbst wenn dieses Wissen zu ganz unterschiedlichen Bereichen gehört, während das Erlernen von Wissen aus einem anderen Bereich für ein KI-basiertes System in der Regel einen Neuanfang bedeutet. Die Anwendung eines bestehenden Algorithmus für maschinelles Lernen auf ein anderes Problem bedeutet, dass die Trainingsphase (das „Lernen”) von vorne beginnt – so als würde man einen Menschen wieder in den Kindergarten schicken, wenn er mit einem neuen Problem konfrontiert wird. Die biologische Intelligenz funktioniert nicht auf diese Weise, aber die künstliche Intelligenz schon.
Das zweite wichtige Thema, das insbesondere aus regulatorischer Sicht ansteht, betrifft die Tatsache, dass die meisten KI-Technologien wie maschinelles Lernen und Deep Learning eine Art „Blackbox” sind – menschliche Anwender definieren die Eingabe und beobachten die Ausgabe, verstehen aber nicht wirklich, warum das System eine bestimmte Ausgabe liefert. Das ist zumindest eine Herausforderung für die Entwicklung, ein Problem für die Aufsichtsbehörden und in gewissem Maße verunsichernd für die Patienten.
Bevor wir unser gesamtes Leben, einschließlich persönlicher Sicherheit und gesundheitsbezogener Entscheidungen, auf künstliche Intelligenz aufbauen – sollten wir dann nicht zumindest verstehen, wie KI funktioniert? Während die meisten von uns intuitiv mit „ja, natürlich” antworten würden, könnten einige argumentieren, dass wir im Laufe der Menschheitsgeschichte biologische Intelligenz aufgebaut und uns auf sie verlassen haben und noch immer nicht ganz verstehen, wie sie funktioniert.
In Anbetracht des Status quo in allen Aspekten hinsichtlich verfügbarer Technologien, rechtlicher und regulatorischer Rahmenbedingungen, der Patientensicherheit, der gesellschaftlichen Akzeptanz und der gegebenen Unterschiede zwischen biologischer und künstlicher Intelligenz erscheint – zumindest derzeit – eine Kombination aus Computerleistung und menschlicher Gehirnleistung als der vorteilhafteste und buchstäblich kongenialste Ansatz.
Zukunft der digitalen Pathologie
Die Entwicklungslinie von Virchows Erkenntnis, dass Zellen die Quelle von Krankheiten sind, bis hin zu KI-gestützten Systemen zur Entscheidungsunterstützung wird jedoch mit unserer Generation nicht zu Ende gehen oder in eine „finale Reifephase” eintreten. Was wir heute miterleben, ist zweifellos spannend, aber nicht mehr als eine Momentaufnahme in der Geschichte.
Irgendwann – möglicherweise im späten 21. Jahrhundert – werden wir vielleicht virtuelle Ärzte haben, aber bis dahin ist es noch ein sehr langer Weg! Das Thema ist nicht nur ein technisches, sondern hat auch starke psychologische, kulturelle und soziale Aspekte. Die Frage lautet nicht „Werden Computer jemals in der Lage sein, Patienten zu diagnostizieren?”, denn wir gehen davon aus, dass die Antwort „Ja” lautet – die erste Frage lautet „Werden die Patienten wollen/akzeptieren, von einem Computer diagnostiziert zu werden?”
Die heutige Computertechnologie würde ausreichen, um ein Passagierflugzeug ohne Piloten zu fliegen – dennoch sitzen in jedem Flugzeug zwei menschliche Piloten. Die Akzeptanz von Computern, die unser Leben kontrollieren, nimmt allgemein zu – in einigen Städten (z.B. in Singapur) sind die U-Bahnen vollständig computergesteuert, es gibt keinen Zugführer mehr, aber in anderen Teilen der Welt wird diese Idee weniger akzeptiert und die Umsetzung hinkt hinterher.
Es wird wahrscheinlich mehrere Jahrzehnte dauern, bis wir in Flugzeugen ohne menschliche Piloten fliegen werden. Bis KI-Systeme die technische Reife, die regulatorische Klarheit, aber auch die soziale Akzeptanz erreichen, dass wir einen virtuellen Hausarzt auf unser Mobiltelefon laden können, oder welches Kommunikationsmittel wir bis dahin auch immer haben werden, könnte es fast oder sogar mehr als ein Jahrhundert dauern. Die meisten unserer derzeitigen Erwartungen werden sich jedoch nicht erfüllen, da in der Zukunft disruptive Technologien auftauchen werden, die uns noch nicht bekannt sind! Diese Technologien werden jedoch die Entwicklung in einer heute noch nicht absehbaren Weise beschleunigen und/oder in eine andere Richtung lenken.
Da der menschliche Geist der Schöpfer der KI ist, sollten wir aus philosophischer Sicht auch über die Frage nachdenken, ob künstliche Intelligenz ein „natürliches Phänomen” ist – zumindest ist es der menschliche Geist.
Wir können davon ausgehen, dass sich die Entwicklung so fortsetzen wird, wie sie es in der Geschichte der Menschheit immer getan hat. Künstliche Intelligenz ist unvermeidlich – und unaufhaltsam.
Dr. Rupert Ecker ist Mitbegründer und CEO des österreichischen Medizintechnikunternehmens TissueGnostics GmbH und Adjunct Professor an der Faculty of Health, School of Biomedical Sciences, an der Queensland University of
Technology.
Dr. Rupert Ecker erklärt, dass die analytischen Lösungen von TissueGnostics es erlauben, mehrere Marker im Gewebe auf Einzelzellebene zu quantifizieren und damit ein wesentliches Werkzeug für die Präzisionsmedizin darstellen.
Daher ist TissueGnostics aktiv an akademischen Kooperationen beteiligt und führt sowohl auf nationaler als auch auf internationaler Ebene Forschungs- und Entwicklungsprojekte durch, um Lösungen an den Grenzen der Wissenschaft und der biomedizinischen Technologie anzubieten.